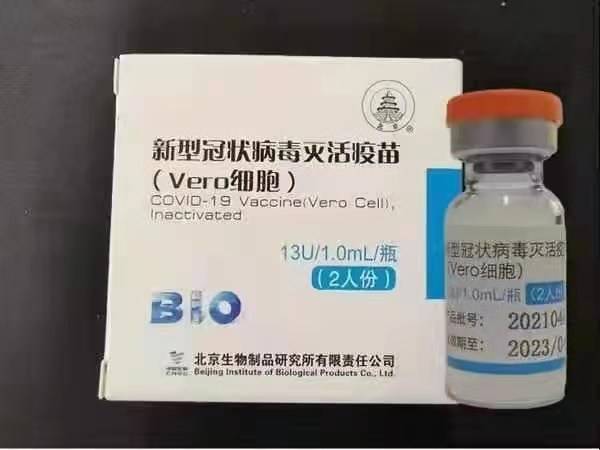
Sinopharm (Beijing): BBIBP-CorV
FASE 1
1 prøveversjon
ChiCTR2000032459
Kina
FASE 2
2 forsøk
NCT04962906
Argentina
ChiCTR2000032459
Kina
FASE 3
6 forsøk
NCT04984408
ChiCTR2000034780
De forente arabiske emirater
NCT04612972
Peru
NCT04510207
Bahrain, Egypt, Jordan, De forente arabiske emirater
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
De forente arabiske emirater
Godkjenninger
WHOs liste over nødstilfeller 59 land
Angola 、 Argentina 、 Bahrain 、 Bangladesh 、 Hviterussland 、 Belize 、 Bolivia (plurinasjonal stat) 、 Brasil 、 Brunei Darussalam 、 Kambodsja 、 Kamerun 、 Tsjad 、 Kina 、 Komorer 、 Egypt 、 Ekvatorialguinea 、 Gabon 、 Gambia 、 Georgia 、 Guyana 、 Ungarn 、 Ungarn 、 、 Iran (Den islamske republikk) 、 Irak 、 Jordan 、 Kirgisistan 、 Laos folkedemokratiske republikk
Libanon 、 Malaysia 、 Maldivene 、 Mauritania 、 auritius 、 Mongolia 、 Montenegro 、 Marokko 、 Mosambik 、 Namibia 、 Nepal 、 Niger 、 Nord -Makedonia 、 Pakistan 、 Paraguay 、 Peru 、 Filippinene 、 Republikken Kongo 、 enegal 、 Serbia 、 Seychellene 、 Sierra Øyer 、 Somalia 、 Sri Lanka 、 Thailand 、 Trinidad og Tobago 、 Tunisia 、 De forente arabiske emirater 、 Venezuela (Bolivar republikk) 、 Vietnam 、 Zimbabwe
Sinopharm BBIBP-CorV COVID-19 er en inaktivert vaksine laget av kulturvoksne viruspartikler som mangler patogen evne. Denne vaksinekandidaten ble utviklet av Sinopharm Holdings og Beijing Institute of Biological Products.
Sinopharm BBIBP-CorV-vaksinen virker ved å la immunsystemet produsere antistoffer mot SARS-CoV-2 beta-koronavirus. Inaktiverte virusvaksiner har blitt brukt i flere tiår, for eksempel rabiesvaksine og hepatitt A -vaksine. Denne utviklingsteknologien har blitt brukt på mange velkjente vaksiner, for eksempel rabiesvaksine.
Sinopharms SARS-CoV-2-stamme (WIV04-stamme og biblioteksnummer MN996528) ble isolert fra en pasient ved Jinyintan sykehus i Wuhan, Kina. Viruset ble forplantet i kultur i en kompetent Vero-cellelinje, og supernatanten av infiserte celler ble inaktivert med β-propiolakton (1: 4000 vol/vol, 2 til 8 ° C) i 48 timer. Etter avklaring av celleavfall og ultrafiltrering ble en andre β-propiolakton-inaktivering utført under de samme betingelsene som den første inaktiveringen. I følge WHO ble vaksinen adsorbert på 0,5 mg alun og lagt i ferdigfylte sprøyter i 0,5 ml sterilt fosfatbuffert saltvann uten konserveringsmidler.
31. desember 2020 kunngjorde State Drug Administration godkjenningen av den eksperimentelle vaksinen utviklet av Sinopharm.
7. mai 2021 kunngjorde Verdens helseorganisasjon godkjennelsen av vaksinen. WHOs nødbruksliste gjorde det mulig for land å påskynde sine egne lovgodkjenninger for å importere og administrere COVID-19-vaksine. WHOs rådgivende ekspertgruppe for immuniseringsstrategier har også fullført sin gjennomgang av vaksinen. Basert på alle tilgjengelige bevis, anbefaler WHO to doser vaksine, med tre til fire ukers mellomrom, for voksne 18 år og eldre. Vaksineeffekten mot symptomatisk og sykehusinnlagt sykdom er estimert til 79% for alle aldersgrupper tilsammen.
The American Medical Association publiserte "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults" 26. mai 2021, og konkluderte med at "i denne prespesifiserte interimanalysen av en randomisert klinisk studie, voksne De 2 inaktiverte SARS-CoV-2-vaksinene som ble administrert i denne prespesifiserte midlertidige analysen av randomiserte kliniske studier reduserte risikoen for symptomatisk COVID-19 betydelig, og alvorlige bivirkninger var sjeldne. " I denne randomiserte fase 3-studien på voksne var effekten av de 2 inaktiverte helvirusvaksinene i symptomatiske COVID-19-tilfeller henholdsvis 72,8% og 78,1%. 2 vaksiner hadde sjeldne alvorlige bivirkninger med samme frekvens som kontrollgruppen for alun, og de fleste var ikke relatert til vaksinasjon. En undersøkende analyse fant at de to vaksinene induserte målbare nøytraliserende antistoffer, lik resultatene av fase 1/2 -studien.
WHO SAGE Working Group publiserte en anmeldelse av Sinopharm/BBIBP COVID-19-vaksinen 10. mai 2021. GAVIs COVID-19-vaksine inneholder en hetteglassmonitor for vaksiner som forteller helsearbeidere om vaksinen er lagret på riktig måte og ikke har blitt utsatt for overoppheting. Som et resultat, skade, rapporterte GAVI 14. mai 2021. smarte etiketter produsert av Zebra Technologies og laget av Temptime Corporation, består av en sirkel med en lysere firkant i midten, laget av en fargeløs kjemikalie som irreversibelt utvikler farge over tid . Dette blir mørkere for å gi en visuell indikasjon på kumulativ varmeeksponering. Når hetteglasset har blitt utsatt for varme utover det optimale lagringsområdet, blir firkanten mørkere enn sirkelen, noe som indikerer at vaksinen ikke lenger skal brukes.
National Drug BBIBP-CorV COVID-19 vaksine legemiddelbiblioteks registreringsnummer: DB15807.